Chemie ist wenn es stinkt und kracht...die alkoholische Gäärung,
alscho die Gäärung desch Allohols isch die alloholische
Gäärung.
Aber was ist Chemie wirklich?
Chemie umfasst die Lehre der kleinsten Teile, der Atome (aus dem
Griechischen: unteilbar), ihren Aufbau, die Reaktion diese Elemente
untereinander und die Analytische Zerlegung aller Materie in ihre
Bestandteile (Moleküle). Sie erklärt im Modell das
Entstehen und die Zusammensetzung der Materialien, sie ist Grundlage
zur Schaffung neuer Werkstoffe - kurz: Sie befasst sich mit dem
mikroskopischen, nicht sichtbaren Mikrokosmos.
Chemie ist eine Naturwissenschaft, die in ihrem Umfang für
Laien nicht oder nur schwer zu begreifen ist. Allerdings sind
grundlegende Gesetzmässigkeiten durchaus auch für Laien
nütig - und sei es nur, damit es nicht kracht und stinkt...
Atommodell nach Bohr
Der Physiker und Chemiker Bohr (1885 - 1962) war als einer der
ersten Wissenschaftler in der Lage, den Aufbau und die
Zusammensetzung von Atomen im Modell nachzuweisen und entwickelte
1913 sein Atommodell auf Grundlage der Vorstellungen E. Rutherfords
und der Quantentheorie von Max Planck, das in Grundzügen auch
heute noch Gültigkeit hat:
Seine Theorie basierte nicht mehr auf dem Atom als solches, da er
erkannte, daß dieses durchaus teilbar ist.
Er unterteilte in seinem Modell das Atom in den Kern
(bestehend aus Neutronen und Protonen), wo die Masse konzentriert ist
und den Kern umkreisende negativ geladene Teilchen, sog. Elektronen,
die die Hülle darstellen. Die Bahnen dieser Elektronen
waren nach seiner Theorie berechenbar.
 Das
Atom wird also von Elektronen in einer Bahn ähnlich der der
Planeten um die Sonne umkreist. Dabei ist die Anzahl der Elektronen
insgesamt abhängig von der Anzahl der Protonen im Kern - sie ist
gleich. Die Anzahl der Elektronen verteilt sich nach Bohr auf
verschiedene Hüllen, die nach der Formel 2n² mit
Elektronen besetzt werden. Allerdings liegen auf der äusseren
(bei Edelgasen), bzw. vorletzten Hülle maximal 8 Elektronen.
Dieses Oktagene Verhalten lässt sich mit dem Bestreben erklären,
das ein Atom/Molekül Edelgaskonfiguration erreichen will. Aus
diesem Ansatz lässt sich das Priodensystem und das
Zustandekommen Chemischer Bindungen erklären.
Das
Atom wird also von Elektronen in einer Bahn ähnlich der der
Planeten um die Sonne umkreist. Dabei ist die Anzahl der Elektronen
insgesamt abhängig von der Anzahl der Protonen im Kern - sie ist
gleich. Die Anzahl der Elektronen verteilt sich nach Bohr auf
verschiedene Hüllen, die nach der Formel 2n² mit
Elektronen besetzt werden. Allerdings liegen auf der äusseren
(bei Edelgasen), bzw. vorletzten Hülle maximal 8 Elektronen.
Dieses Oktagene Verhalten lässt sich mit dem Bestreben erklären,
das ein Atom/Molekül Edelgaskonfiguration erreichen will. Aus
diesem Ansatz lässt sich das Priodensystem und das
Zustandekommen Chemischer Bindungen erklären.
Das Periodensystem wurde entwickelt, um die bekannten Atome in
eine logische Ordnung zu bringen. Als Ordnungszahl verwandten die
Entwickler dabei die Anzahl der Protonen im Kern des Atoms (Beispiel
Wasserstoff (H), 1 Proton, 1 Neutron, 1 Elektron Ordnungszahl 1). Die
Anzahl der freien (Valenz-)elektronen ergaben die Einteilung in die
acht Hauptgruppen I bis VIII. Die Anzahl der (Elektronen-) Schalen
ist aus der Zeile zu erkennen: 1te Zeile - 1 Schale, 2te Zeile - 2
Schalen, usw. Zudem wurden gleichzeitig die Massezahlen ( Protonen +
Neutronen) mit in die Tabelle aufgenommen.
| Erweitertes Periodensystem |
|---|
| Gruppe → |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
| (CAS) |
I A |
II A |
III B |
IV B |
V B |
VI B |
VII B |
VIII B |
VIII B |
VIII B |
I B |
II B |
III A |
IV A |
V A |
VI A |
VII A |
VIII A |
|
| Periode ↓ |
|
Schale ↓ |
| 1 |
H 1 |
|
He 2 |
K |
| 2 |
Li 3 |
Be 4 |
|
B 5 |
C 6 |
N 7 |
O 8 |
F 9 |
Ne 10 |
L |
| 3 |
Na 11 |
Mg 12 |
|
Al 13 |
Si 14 |
P 15 |
S 16 |
Cl 17 |
Ar 18 |
M |
| 4 |
K 19 |
Ca 20 |
Sc 21 |
Ti 22 |
V 23 |
Cr 24 |
Mn 25 |
Fe 26 |
Co 27 |
Ni 28 |
Cu 29 |
Zn 30 |
Ga 31 |
Ge 32 |
As 33 |
Se 34 |
Br 35 |
Kr 36 |
N |
| 5 |
Rb 37 |
Sr 38 |
Y 39 |
Zr 40 |
Nb 41 |
Mo 42 |
Tc 43 |
Ru 44 |
Rh 45 |
Pd 46 |
Ag 47 |
Cd 48 |
In 49 |
Sn 50 |
Sb 51 |
Te 52 |
I 53 |
Xe 54 |
O |
| 6 |
Cs 55 |
Ba 56 |
La* |
Hf 72 |
Ta 73 |
W 74 |
Re 75 |
Os 76 |
Ir 77 |
Pt 78 |
Au 79 |
Hg 80 |
Tl 81 |
Pb 82 |
Bi 83 |
Po 84 |
At 85 |
Rn 86 |
P |
| 7 |
Fr 87 |
Ra 88 |
Ac** |
Rf 104 |
Db 105 |
Sg 106 |
Bh 107 |
Hs 108 |
Mt 109 |
Ds 110 |
Rg 111 |
|
Q |
| |
| |
La: |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
| (*6) |
|
|
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
|
|
| (*7) |
|
|
AC: |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
|
|
| |
89 |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
|
|
| |
| Nichtmetalle: |
|
H |
Formelzeichen: |
steht für die Bezeichung des Elementes |
| |
sonstige Nichtmetalle |
|
1 |
Ordnungszahl: |
gibt Anzahl der Protonen im Kern an (und indirekt auch die Anzahl der Elektronen) |
| |
Halogene |
|
|
| |
Edelgase |
|
| Metalle: |
|
Periode: |
Anzahl der Schalen, die mit Elektronen gefüllt werden |
| |
Alkalimetalle |
| Gruppe: |
Alle Elemente einer Gruppe besitzen die gleiche Anzahl an Valenzelektronen und haben daher ähnliche chemische Eigenschaften, Es gibt 8 Hauptgruppen(1,2 und 13 bis 18) und 10 Nebengruppen (3 bis 12). |
| |
Erdalkalimetalle |
|
| |
Halbmetalle |
| Schale |
Benennung der Schalen eines Atoms, die mit Elektronen gefüllt sind ab der 2ten Schale unterteilen sich diese in Unterschalen, die äußerste dieser Unterschalen gibt die Anzahl der Valenzelektronen wieder. |
| |
Übergangsmetalle |
|
| |
Metalle |
| |
K |
L |
M |
N |
O |
P |
Q |
| Sonderelemente |
|
max e |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
| |
Lantanoide |
|
Summe e |
2 |
10 |
18 |
36 |
54 |
86 |
118 |
| |
Actinoide |
|
Unterschalen |
1s |
2s2p |
3s3p |
4s3d4p |
5s4d56 |
6s4f5d6p |
7s5f6d7p |
| |
|
|
|
|
|
|
|
Anzahl e |
2 |
2+6 |
2+10+6 |
2+14+10+6 |
| |
Aus diesem System lässt sich das Verhalten eines Elementes
und mögliche Bindungen direkt ablesen:
Beispielsweise wird ein links stehendes Element (z.B. Wasserstoff)
sich ein rechtsstehendes Element (z.B. Sauerstoff) suchen, um eine
Verbindung einzugehen ( Ergebnis: Wasser H2O) Dabei ist
auch die Anzahl des jeweiligen Elementes in der Verbindung
abzuleiten. Zu den Bindungsarten kommen wir später.
Analyse
Analyse - Synthese - Mischung - Verbindung
Analyse: Auseinandernehmen eines Stoffes, Zerlegen in Bestandteile
dabei unterscheidet man zwischen:
Mechanischer Analyse (Siebung, Filterung, Sortieren,
Extraktion), die bei Mischungen zum Erfolg führen, und
Chemischer Analyse (Destilation, Schmelzung, Kathalysierte
Reaktion, Extraktion) die bei Verbindungen zum Erfolg führt.
Synthese: Verbinden / Verschmelzen von Stoffen zu einem Neuen,
d.h. Synthese zweier Stoffe erzeugt einen neuen Stoff, der durch
einfache mechanische Analyse nicht mehr zu den Ausgangsstoffen gefürt
werden kann. Diese Stoffe nennt man chemische
Verbindungen.
Beispiele: Herstellung von syntetischen
Farbstoffen
Herstellung von Kunstfasern (Nylon,
Perlon)
Herstellung von Gummi (Buna)
Herstellung von
Kunststoffen (Zellulose, PVC, Polymere)
chemischer Vorgang: Verbrennung(Oxidation) Korrosion (Oxidation)
alkoholische Gärung, Elektrolyse, Synthese eines neuen Stoffes
physikalischer Vorgang: Verformung, Temperaturänderung und
damit Änderung des Aggregatzustandes (Fest- Flüssig-Gasförmig),
Energiezuführung oder Entzug (Akku), Mischen - Änderung der
äußeren Eigenschaften ohne die Stoffe selbst zu verändern
- "leicht" reversibel (rückführbar)
Extraktion: herauslösen von Bestandteilen eines Stoffes durch
Lösungsmittel - z.B. Kaffeekochen
Atome bilden in der Natur Moleküle, d.h. sie kommen selten
atomar (also in ihrer reinen Form) vor. Moleküle sind also
zusammengesetzte Atome, deren Verbindung in unterschiedlicher Form
und Stabilität vorliegt. Man unterscheidet drei Bindungsarten:
Ionenbindung Metalle und Nichtmetalle bilden über die
gemeinsame Nutzung ihrer Valenzelektronen ein Molekül. Diese
Verbindung nennt man Salze oder Salzkristalle:
Beispiel: Na und
Cl -> NaCl Natriumchlorid (Kochsalz)
Feste und stabile,
bipolare (+ - ) Bindung mit hohem Schmelzpunkt.
Atombindung Nur Nichtmetalle gehen diese Bindungsart ein. Sie
entsteht über eine Elektronenpaabindung, d.h. sie teilen sich
gemeinsam paarweise freie Elektronen.
Beispiel: H + H -> H2
(Wasserstoffgas) O+O -> O2 (Sauerstoffgas)
Diese Verbindungen sind nicht besonders stabil und besitzen
einen niedrigen Schmelzpunkt
Metallbindungen Wie der Name schon sagt: Metalle gehen diese
Bindungsart ein. Sie bilden ein sog. Metallgitter, bei dem die Atome
ihre freien Elektronen als Elektronengas ungebunden zwischen den
Atomkernen belassen. Die starken Coulombkräfte sorgen für
eine starke, stabile Bindung mit hohem Schmelzpunkt. Weitere
Eigenschaft: hohe elektrische Leitfähigkeit (Wegen der freien
Elektronen)
Oxidation ist ein chemischer Prozess, bei dem das oxidierte
Element (meist) Sauerstoff aufnimmt und dabei Elektronen an den
Oxidanten (Oxidationsmittel) abgibt.
Einige Oxidationsmittel: Wasserstoffperoxid H2O2
, Kaliumpermanganat KmnO4, Salpeter KNO3
Reduktion
Reduktion ist die entgegengesetzte Reaktion zur Oxidation, d.h.
Sauerstoff wird einer Verbindung entzogen und Elektronen werden
aufgenommen.
Einige Reduktionsmittel: Wasserstoff H2, Natrium Na,
Kohlenstoff C
Somit ist logischerweise jede Oxidation mit einer Reduktion des
Oxidanten verbunden! Daher nennt man diesen Prozess auch
Redoxreaktion.
Laugen sind chemische Verbindungen die durch Einleiten von
Wasserlöslichen Metalloxiden (z.B. K2O = Kaliumoxid) in Wasser,
oder der Reaktion unedler Metalle mit Wasser (Na = Natrium)
entstehen.
Charakteristisch für Laugen sind die dabei entstehenden OH -
Gruppen, die stark reaktiv sind.
Laugen färben Lackmuspapier blau
Laugen sind basisch / alkalisch
Beim Verdampfen von Laugen entstehen Metallhydroxide
Diese Zerfallen beim Lösen in Wasser zu Metallionen und
Hydroxionen
Beispiele: NaOH (Natronlauge) KOH (Kalilauge)
Säuren sind chemische Verbindungen, bei denen die
Wasserstoffatome derart angelagert sind, dass sie dieser Verbindung
leicht entzogen werden können (Dissoziation - Entzug von
Wasserstoff). Auf dieser Eigenschaft beruht die Säurecharakteristik
dieser Chemischen Verbindungen.
Ihre Säurewirkung entfalten diese Verbindungen erst durch
Einleitung in oder Kontakt mit Wasser. Daher ist auch leicht zu
erklären, warum Schleimhäute besonders durch Säuren
angegriffen werden können.
Säuren färben Lackmuspapier rot
Säuren reagieren stark und sauer
Säurewirkung durch positive Wasserstoffionen H+
Ätzwirkung bei Metallen, Haut und Schleimhäuten
Redundante (dissoziative) Wirkung
Beispiele: Kohlensäure H2CO3 (
schwache, natürliche Säure)
Phosphorsäure
H3PO4 ( mittelstarke Säure)
Salzsäure HCl ( starke
Säure(gas))
Salpetersäure HNO3 ( starke
Säure)
Schwefelsäure H2SO4 (
sehr starke natürliche Säure)
Einteilung in organische (Kohlenstoffverbindung) und
anorganische (-ide) Säuren
Neutralisation
nennt man die Verbindung von Säuren und Basen (Laugen) zu
Salz und Wasser.
Also entsteht Wasser durch die Reaktion der OH - Gruppe der Lauge
(-hydroxid) mit den Wasserstoffionen H+ der Säure - das Metall
der Lauge reagiert mit der negativ geladenen Oxidationsgruppe der
Säure - es entsteht Salz.
Beispiel: Natronlauge und Salzsäure werden zusammengeleitet,
die beiden Stoffe ragieren zu Wasser und Kochsalz
NaOH + HCl => Na+ OH - + H+ +
CL- => NaCL + H2O
Zur Erklärung: das hochgestellte + bedeutet eine positive
Ladung des Ions durch Verlust eine Elektrons, das hochgestellte Minus
die negative Ladung des Ions durch Überschuss eines Elektrons.
Chemische Reaktionsgleichungen erklären die Zusammensetzung
und mengenmässige Relation der Ausgangsstoffe und des Produktes
einer Reaktion.
Wir nehmen als Beispiel die Neutralisation von Natronlauge und
Schwefelsäure
NaOH + H2SO4 = Na SO4 + H2O
=> Na+ + OH- + 2H+ +
SO4(2-) = Na SO4 + H2O
Wir sehen, dass beide Seiten
nicht gleich sind, da 2 H nicht mit einer OH-Gruppe zu
H2O reagieren kann. es müssen wenigstens 2 OH - Gruppen
sein
Ausserdem benötigt die SO4-Gruppe wenigstens zwei positive
Ionen zum Aufbau einer neutralen Bindung also z.B. 2 Na+ ! Daraus
folgt dann, dass die Reaktionsgleichung wie folgt aussehen muss:
2 NaOH + H2 SO4 = NaSO4
+ 2 H2O
Allgemein ausgedrückt bedeutet dies, dass die Summe der
Einzelelemente auf der linken Seite gleich der Summe der Elemente auf
der rechten Seite sein muss!
Also:
A + B = C + D => xA + B = C +xD => A+xB = xC + D
Die Linke Seite dieser Gleichung enthält die Ausgangsstoffe,
die rechte die Reaktionsprodukte
Aus der Geschichte der Chemie, die als Wissenschaft erst spät
den Absprung von der mysthifizierenden Alchemie des Mittelalters
schaffte, erwuchs der Versuch, Chemie in natürliche und
unnatürliche Chemie zu teilen
Letzlich ist die Unterscheidung zwischen organischer (natürlicher)
und anorganischer Chemie an das Vorkommen von Kohlenstoff in der
Verbindung geknüpft - wenngleich die Übergänge
fliessend und nicht klar getrennt werden.
Organische Chemie
Diese wird auch Kohlenstoffchemie genannt Wie aus dem Namen
bereits hervorgeht befasst sich diese Teil der Chemie mit allen
Verbindungen, die Kohlenstoff in freier oder gebundenenr Form
enthällt. Als wichtigstes Teilgebeit ist hier die Biochemie zu
nennen, die sich mit den Vorgängen in den Pflanzen, der
sogenannten Fotolyse und Fotosynthese( Umwandlung von CO2
in Zucker und Sauerstoff ) befasst.
Organische Verbindung:
Kohlenwasserstoffverbindungen wie z.B. Zucker, Stärke, Mehl,
Kohlendioxide, Kohlensäure, Kristalle, Bernstein, Diamant,
Kohle, Erdöl, usw...
können lange Ketten von Molekülen bilden - sogenannte
Makromoleküle
Schweflige Kohlenstoffverbindungen, Aminosäuren sind
Beispiele.
Folgend eine tabellarische Auflistung der organischen Verbindungen
|
Name |
Atomanordnung |
Allgemeine Formel |
Vertreter der Gruppe |
|
Kohlenwasserstoffe |
|
Alkane |
C-C (Einfachbindung) |
Cn H2n+2 |
Methan CH4,
Ethan C2H6 |
|
Alkene |
C=C (Doppelbindung) |
CnH2n |
Ethen C2H4 ,
Propen C3H6 |
|
Alkine |
C=C (Dreifacbindung) |
CnH2n-2 |
Ethin C2H2 ,
Propin |
|
Aromatische Kohlenwasserstoffe |
Benzolringe |
|
Benzol, Tuluol, Naphtalin |
|
Sauerstoffhaltige Verbindungen |
|
Alkohole |
Hydroxylgruppen(-OH) |
Cn-H2n+1OH |
Methanol CH3OH
Ethanol CH3CH2OH |
|
Aldehyde |
Aldehydgruppe |
|
Methanal |
|
Ketone |
Carbonylgruppe |
|
Aceton |
|
Carbonsäuren |
Carboxylgruppe |
|
Ethansäure |
|
Ester |
Estergruppe |
|
Butansäureesther |
|
Ether |
|
|
Diethylether |
|
Stickstoffhaltige Verbindung |
|
Amine |
-NH2 |
|
Harnstoff |
|
Aminosäuren |
|
|
Aminoethansäure |
|
Nitroverbindungen |
|
|
Trinitroglycerinsäure |
|
Nitrile |
|
|
Blausäure |
|
Schwefelhaltige Verbindung |
|
Thiole |
-SH |
|
Methanthiol |
|
Sulfonsäuren |
-SO3H |
|
Tuluololslfonsäure |
Anorganische Chemie
Diese beschäftigt sich mit allen nichtbiologischen und künstlich hergestellten, synthetischen Stoffen. Obgleich die
Produktion sogenannter Polymeride, Polystyrole und Polychloride hierzu zählen, sind in diesen Kunststoffen durchaus
Kohlenstoffatome vorhanden ( Erdöl als Rohstoff ist letztlich ja nichts anderes als Überbleibsel von Pflanzen ) und zählen
wieder zur organischen Chemie... Hier sind die Grenzen also fließend.
In der Chemie werden Atome, Moleküle und Verbindungen meist nicht bildlich (sieh Atommodell), sondern in Summen oder
Strukturschreibweise mit den Bezeichnungsbuchstaben der einzelnen Elemente dargestellt
Anhand des Wasserstoffes (H) und Sauerstoffs (O) verbildlichen wir diese unterschiedliche Schreibweise:
| H .. H, :O::O: |
Elektronenschreibweise |
| H-H, O=O |
Elektronenpaarschreibweise"Strukturformel"(Die nicht beteiligten Elektronen werden "vergessen") |
| H2 , O2 |
Molekulearschreibweise "Summenformel" |
| H-O-H |
Wasser : Summenformel H2 + O2 = 2 H2O |
| O=C=O |
Kohlendioxid: C + O2 = CO2 |
| Na - OH |
Natriumhydroxid (Natronlauge): Na + OH = NaOH |
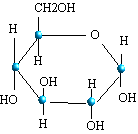 |
Zucker oder Glucose = C6H12O6 |
Es ist also ersichtlich, dass die Strukturformel eher Aufschluss über das Aussehen eines Moleküls gibt als die Summenformel.
Kunststoffe haben heutzutage eine große Bedeutung in der Industrie, in der Medizin und weiten Teilen des
privaten Lebens. Kaum etwas hat die Pridukzionsweise und das Aussehen von Gebrauchsgütern so revolutioniert wie die durch die
chemische Industrie erzeugten Kunststoffe.
Kunsstoffe lassen sich grundsätzlich in drei Typen unterteilen:
Duroplaste: engmaschig vernetzte Makromoleküle.
Sie sind weitgehends stabil in ihrem Temperaturverhalten, d.h. sie
ändern ihre mechanischen und chemischen Eigenschaften nur
unwesentlich. Sie sind daher nicht formbar und nicht schweißbar
Thermoplaste: fadenförmige nicht verkettete
Makromoleküle. Sie haben bei Raumtemparatur durch ihre
Verknäuelung eine relativ hohe Stabilität, die durch
Erwärmung allerdings abnimmt. Sie lassen sich somit leicht
formen und schweißen
Elastomere: weitmaschig vernetzte Makromoleküle.
Sie können mechanischen Einwirkungen flexibel widerstehen, d.h.
sie dehnen und verformen sich unter mechanischer Belastung, ohne
ihre Form nachhaltig zu verändern - Somit sind Sie nicht
formbar und nicht schweißbar.
Allen Kunststoffen gemein sind folgende typische Eigenschaften:
|
Positive Eigenschaften |
negative Merkmale |
|
geringe Dichte
variable mechanische Eigenschaften
elektrisch nicht leitend (Isolation)
Korrosionsbeständig
gut form- und bearbeitbar
leicht einzufärben
- Wärme und Kälteisolierend
|
|
Verarbeitung von Kunststoffen
Kunststoffe herzustellen ist Sache derChemischen
Industrie - Doch Kunststoffe selbst sind ohne praktischen Nutzen,
d.h. erst ihre Verarbeitung macht sie zu Gebrauchsgegenständen
Es gibt verschiedene Arbeitsmethoden um die
pulverförmigen oder als Granulat angelieferten Rohkunststoffe zu
verarbeiten:
Bei thermoplasten Kunststoffen :
Spritzgießen: (Gehäuse und Formteile)
Extrudieren: (Profile, Rohre)
Blasen: (Folien)
Blasformen: (Flaschen, große Hohlgefäße, Behälter)
Duroplaste: meist durch Formpressen
Elastomere: meist durch Gießen
 Das
Atom wird also von Elektronen in einer Bahn ähnlich der der
Planeten um die Sonne umkreist. Dabei ist die Anzahl der Elektronen
insgesamt abhängig von der Anzahl der Protonen im Kern - sie ist
gleich. Die Anzahl der Elektronen verteilt sich nach Bohr auf
verschiedene Hüllen, die nach der Formel 2n² mit
Elektronen besetzt werden. Allerdings liegen auf der äusseren
(bei Edelgasen), bzw. vorletzten Hülle maximal 8 Elektronen.
Dieses Oktagene Verhalten lässt sich mit dem Bestreben erklären,
das ein Atom/Molekül Edelgaskonfiguration erreichen will. Aus
diesem Ansatz lässt sich das Priodensystem und das
Zustandekommen Chemischer Bindungen erklären.
Das
Atom wird also von Elektronen in einer Bahn ähnlich der der
Planeten um die Sonne umkreist. Dabei ist die Anzahl der Elektronen
insgesamt abhängig von der Anzahl der Protonen im Kern - sie ist
gleich. Die Anzahl der Elektronen verteilt sich nach Bohr auf
verschiedene Hüllen, die nach der Formel 2n² mit
Elektronen besetzt werden. Allerdings liegen auf der äusseren
(bei Edelgasen), bzw. vorletzten Hülle maximal 8 Elektronen.
Dieses Oktagene Verhalten lässt sich mit dem Bestreben erklären,
das ein Atom/Molekül Edelgaskonfiguration erreichen will. Aus
diesem Ansatz lässt sich das Priodensystem und das
Zustandekommen Chemischer Bindungen erklären.